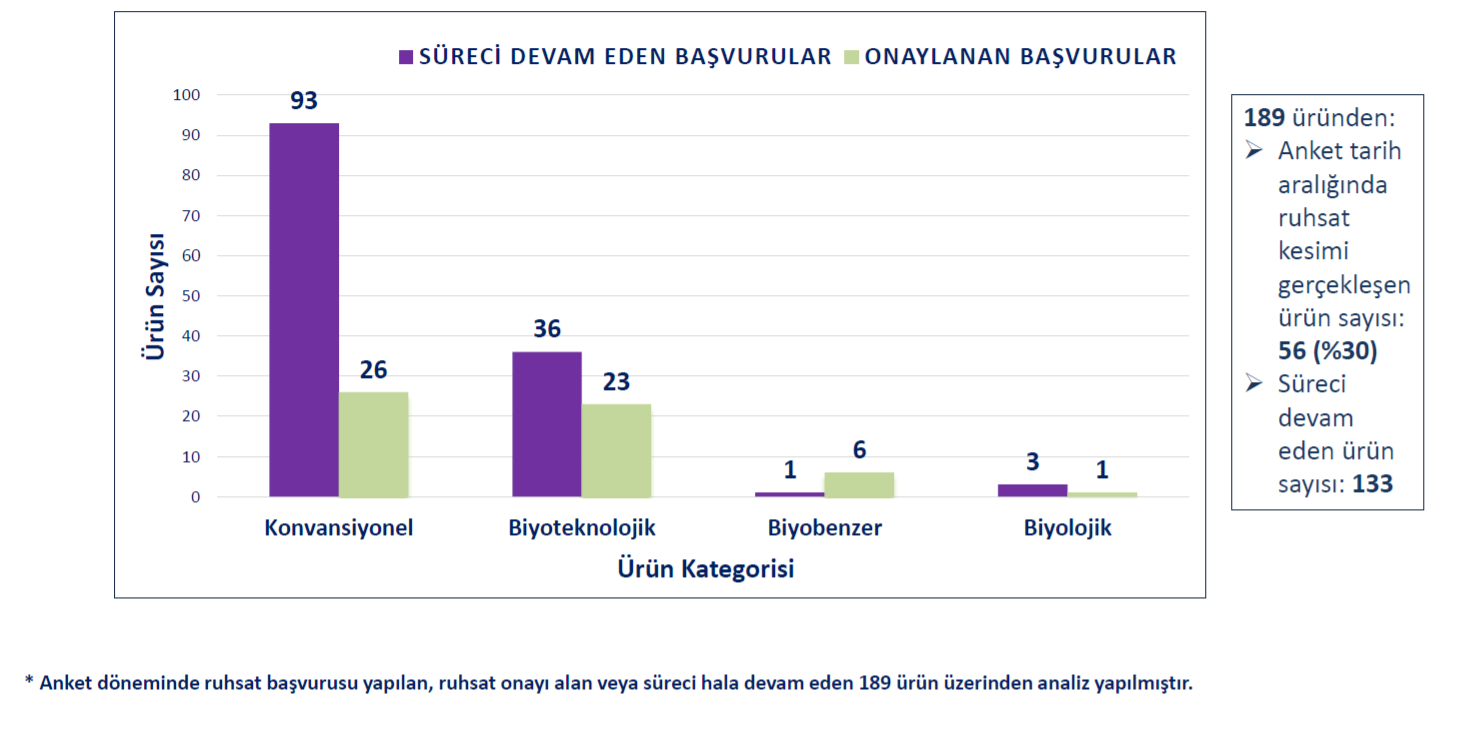
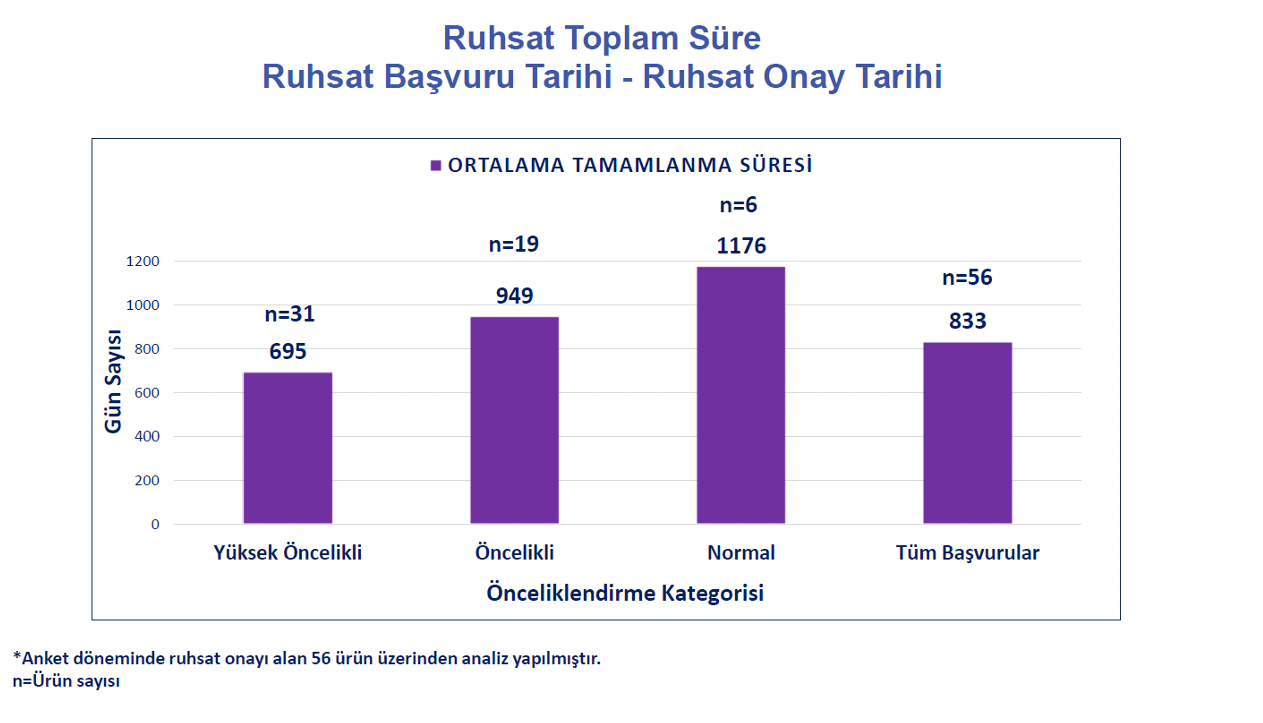
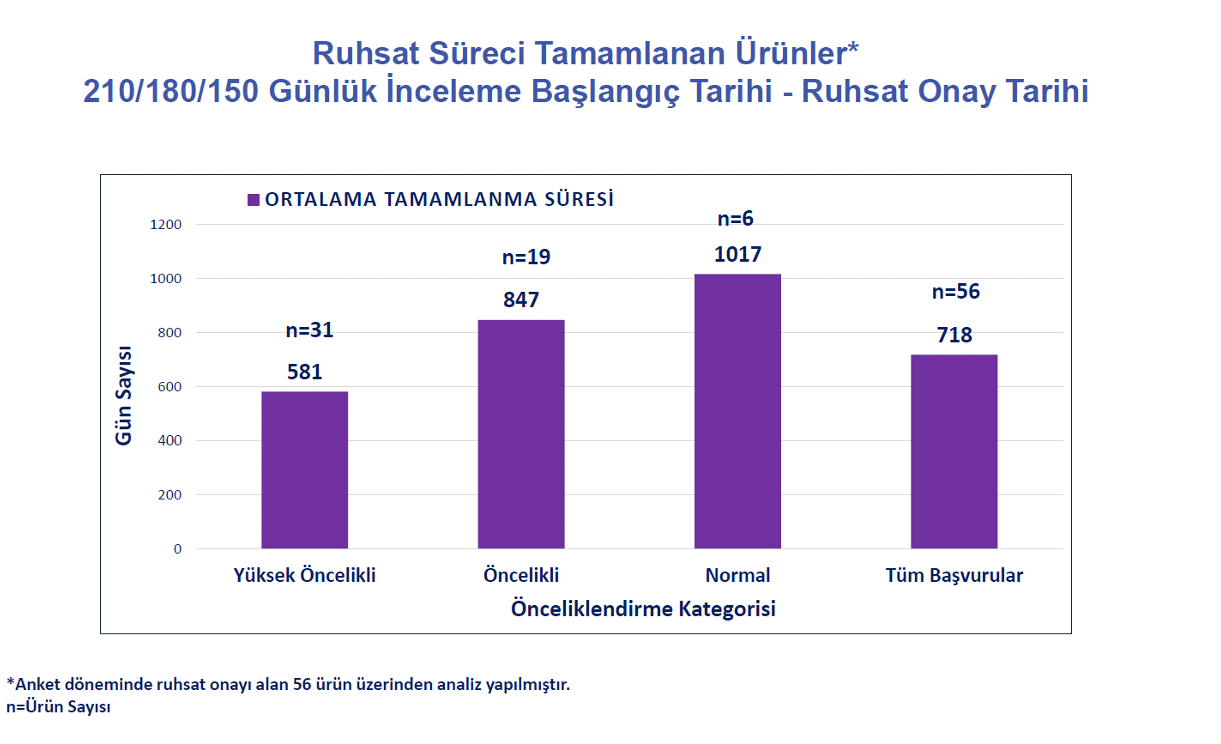
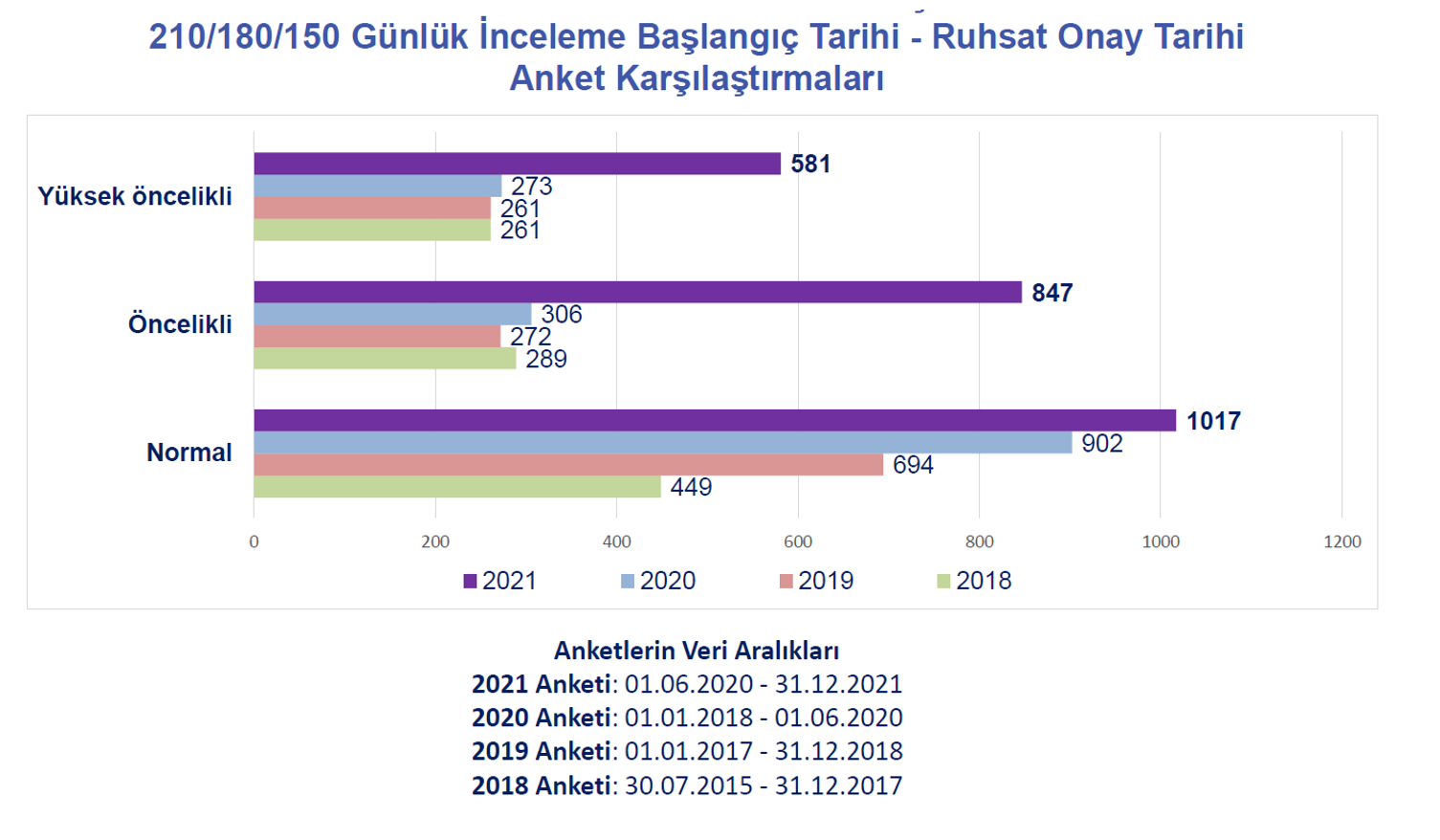
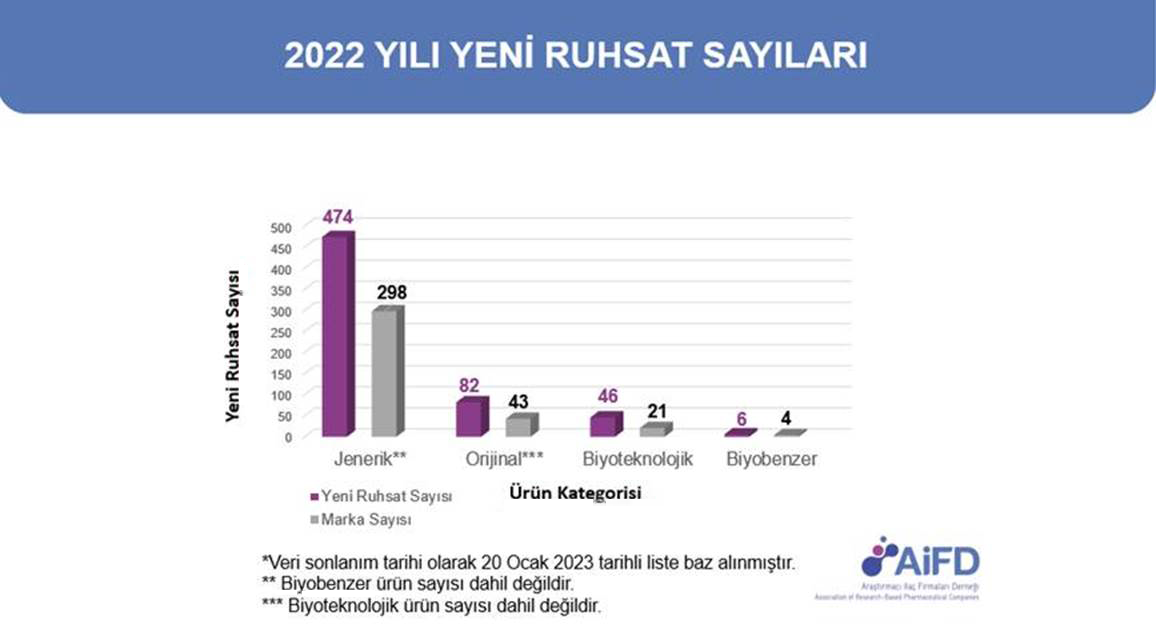
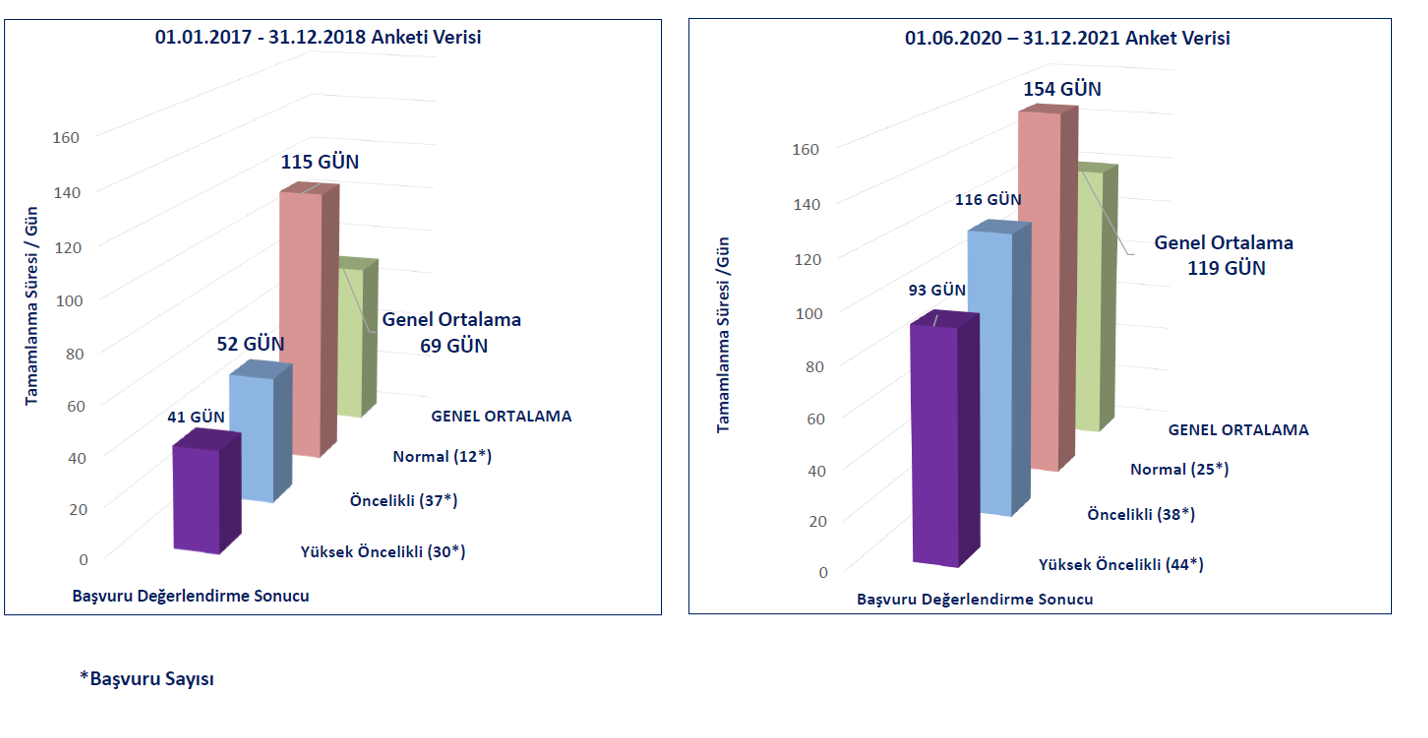
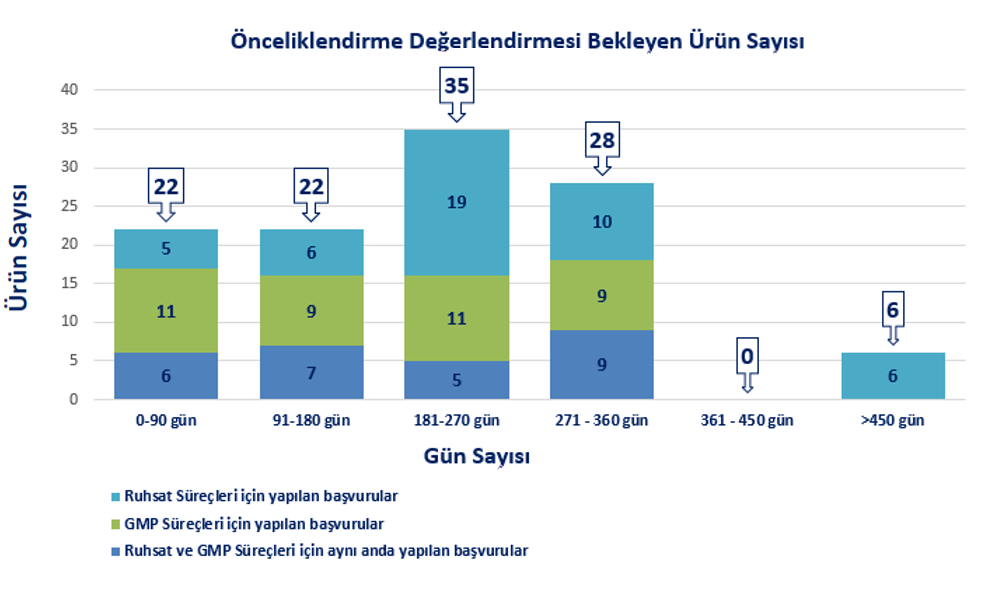
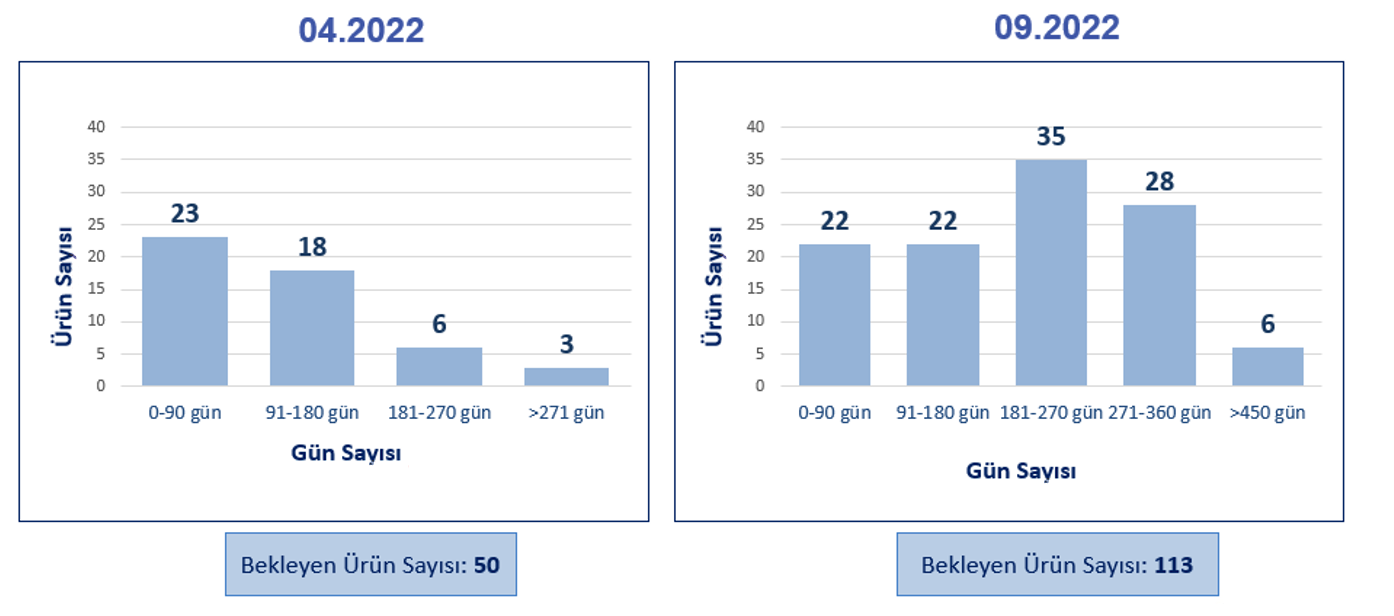
|
YAYIN TARİHİ |
İLGİLİ DAİRE |
MEVZUAT-DUYURU |
|
18/01/2022 |
İlaç Ruhsatlandırma Daire Başkanlığı |
11.12.2021 tarihinde yayınlanan Beşeri Tıbbi Ürünler
Ruhsatlandırma Yönetmeliği kapsamında Başvuru Formu ve CTD
Kılavuzu revizyonu +
|
|
20/01/2022 |
İlaç Ruhsatlandırma Daire Başkanlığı |
* Ruhsatlı Beşeri Tıbbi Ürünlerdeki Varyasyonlara Dair
Kılavuz
|
|
26/01/2022 |
Bitkisel ve Destek Ürünler Dairesi Başkanlığı |
Özel Tıbbi Amaçlı Gıdalara İzin Verilmesi Hakkında Yönetmelik Taslağı |
|
11/02/2022 |
İlaç Denetim Dairesi Başkanlığı |
Seri Serbest Bırakma Kılavuzu |
|
15/02/2022 |
İlaç Denetim Dairesi Başkanlığı |
İyi Dağıtım Uygulamaları Denetimlerine İlişkin Kılavuz |
|
25/02/2022 |
İlaç Denetim Dairesi Başkanlığı |
* Biyoyararlanım/Biyoeşdeğerlik Çalışmalarının Denetimleri
İçin Tetikleyiciler Hakkında Kılavuz
|
|
08/03/2022 |
İlaç Denetim Dairesi Başkanlığı |
İyi Klinik Uygulamaları Denetimleri İçin Başvuru Kılavuzu |
|
08/03/2022 |
Bitkisel ve Destek Ürünler Dairesi Başkanlığı |
Sağlık Beyanı Kullanımı Hakkında Yönetmelik Taslağı |
|
09/03/2022 |
İlaç Ruhsatlandırma Daire Başkanlığı |
Alerjen Ürünlerin Ruhsatlandırılmasına İlişkin Kılavuz |
|
12/03/2022 |
İlaç Denetim Dairesi Başkanlığı |
Yurt Dışı GMP Denetimleri ve Sertifikasyon Süreçleri Hakkında Pandemi Sürecinde Uygulanacak Ek Tedbirler |
|
15/03/2022 |
Bitkisel ve Destek Ürünler Dairesi Başkanlığı |
* Homeopatik Tıbbi Ürünler Ruhsat Başvurusu Hakkında
Kılavuz
|
|
15/03/2022 |
Strateji Geliştirme Daire Başkanlığı |
Türkiye İlaç ve Tıbbi Cihaz Kurumu İletişim İşbirliği ve Bilgi Paylaşımı Kılavuzu |
|
14/04/2022 |
İlaç Ruhsatlandırma Daire Başkanlığı |
Çeşitleme Başvuruları ile Varyasyon Başvurularının Sınıflandırmasına Dair Kılavuz |
|
22/04/2022 |
İlaç Denetim Dairesi Başkanlığı |
Beşeri Tıbbi Ürünler İmalathaneleri İyi İmalat Uygulamaları (GMP) Kılavuzu |
|
22/04/2022 |
İlaç Denetim Dairesi Başkanlığı |
Piyasa Kontrol Programlarında Paydaşların İletişim, Organizasyon ve Sorumlulukları Hakkında Kılavuz |
|
27/04/2022 |
Farmakovijilans ve Kontrole Tabi Maddeler Dairesi Başkanlığı |
Farmakovijilans Faaliyetlerinde Kriz Yönetimi Rehberi |
|
27/04/2022 |
Farmakovijilans ve Kontrole Tabi Maddeler Dairesi Başkanlığı |
İyi Farmakovijilans Uygulamaları (İFU) Kılavuzu Modül IX EK I – Eğitim Materyalleri |
|
27/04/2022 |
Farmakovijilans ve Kontrole Tabi Maddeler Dairesi Başkanlığı |
İyi Farmakovijilans Uygulamaları (İFU) Kılavuzu Modül IX – Risk Minimizasyon Önlemleri: Araçların Seçimi ve Etkinlik İndikatörleri |
|
27/04/2022 |
Farmakovijilans ve Kontrole Tabi Maddeler Dairesi Başkanlığı |
İyi Farmakovijilans Uygulamaları (İFU) Kılavuzu Modül VIII – Güvenlilik İletişimi |
|
28/04/2022 |
İlaç Ruhsatlandırma Daire Başkanlığı |
Beşeri Tıbbi Ürünlerin Biyoyararlanım ve Biyoeşdeğerliğinin İncelenmesi Hakkında Kılavuz |
|
11/05/2022 |
Strateji Geliştirme Daire Başkanlığı |
İyi Düzenleme Uygulamaları Kılavuzu |
|
07/06/2022 |
Bitkisel ve Destek Ürünler Dairesi Başkanlığı |
Yeni Sağlık Beyanı Başvuru Kılavuz Taslağı |
|
07/06/2022 |
Bitkisel ve Destek Ürünler Dairesi Başkanlığı |
Özel Tıbbi Amaçlı Gıdaların Ambalaj Bilgilerine ve Okunabilirliklerine İlişkin Kılavuz Taslağı |
|
10/06/2022 |
İlaç Denetim Dairesi Başkanlığı |
Beşeri Tıbbi Ürünler İmalathaneleri Yönetmeliğinde Değişiklik Yapılmasına Dair Yönetmelik |
|
16/06/2022 |
İlaç Denetim Dairesi Başkanlığı |
"Alerjen Ürünlerin Ruhsatlandırılması Aşamasında Gerekli Olan GMP Süreçleri" Hakkında Duyuru |
|
20/06/2022 |
Bitkisel ve Destek Ürünler Dairesi Başkanlığı |
* Sağlık Beyanı Kullanımı Hakkında Kılavuz Taslağı
|
|
20/06/2022 |
Bitkisel ve Destek Ürünler Dairesi Başkanlığı |
"Hedara Helix L. İçeren Geleneksel Bitkisel Tıbbi Ürünler" hakkında duyuru |
|
20/06/2022 |
Farmakovijilans ve Kontrole Tabi Maddeler Dairesi Başkanlığı |
İyi Farmakovijilans Uygulamaları (İFU) Kılavuzu Modül X - Pazarlama Öncesi Yarar/Risk Değerlendirmesi |
|
20/06/2022 |
Farmakovijilans ve Kontrole Tabi Maddeler Dairesi Başkanlığı |
İyi Farmakovijilans Uygulamaları (İFU) Kılavuzu Modül XI - Pazarlama Sonrası Yarar/Risk Değerlendirmesi |
|
07/07/2022 |
Analiz ve Kontrol Laboratuvarı Dairesi Başkanlığı |
Numune Kabul Kriterleri Prosedürü Revizyonu |
|
03/08/2022 |
İlaç Ruhsatlandırma Daire Başkanlığı |
"COVID-19 Pandemisi Nedeni ile İlaç Ruhsatlandırma Dairesi Başkanlığı İş ve İşlemlerinde Düzenleme"ye ilişkin duyuru (Bu duyuruya istinaden 26 Ağustos tarihli duyuru geçerliliğini yitirmiştir) |
|
03/08/2022 |
Farmakovijilans ve Kontrole Tabi Maddeler Dairesi Başkanlığı |
İyi Farmakovijilans Uygulamaları Kılavuzu
|
|
09/08/2022 |
İlaç Denetim Dairesi Başkanlığı |
Risk Bazlı İyi Klinik Uygulamaları Denetimleri Hakkında Kılavuz |
|
09/08/2022 |
İlaç Denetim Dairesi Başkanlığı |
İyi İmalat Uygulamaları Değerlendirmeleri İçin Güven Kılavuzu |
|
11/08/2022 |
Farmakovijilans ve Kontrole Tabi Maddeler Dairesi Başkanlığı |
İyi Farmakovijilans Uygulamaları (İFU) Kılavuzu Modül VI -
Risk Yönetimi Sistemleri
|
|
11/08/2022 |
Analiz ve Kontrol Laboratuvarı Dairesi Başkanlığı |
Aşı ve İmmun Serumlar Hakkında Seri Serbest Bırakma Kılavuzu |
|
12/08/2022 |
İlaç Denetim Dairesi Başkanlığı |
Beşeri Tıbbi Ürünler İçin İyi Dağıtım Uygulamaları (GDP) Kılavuzu |
|
25/08/2022 |
Farmakovijilans ve Kontrole Tabi Maddeler Dairesi Başkanlığı |
İyi Farmakovijilans Uygulamaları (İFU) Kılavuzu Modül III -Periyodik Yarar/Risk Değerlendirme Raporu |
|
25/08/2022 |
Farmakovijilans ve Kontrole Tabi Maddeler Dairesi Başkanlığı |
Farmakovijilans İndikatörleri Rehberi |
|
26/08/2022 |
İlaç Ruhsatlandırma Daire Başkanlığı |
"Ruhsatlı Beşeri Tıbbi Ürünlerin varyasyon başvurularının tedarik sorunlarına yönelik olarak önceliklendirme talebi başvuruları" duyurusu |
|
29/08/2022 |
Akılcı İlaç Kullanımı Daire Başkanlığı |
Yurtdışından Yapılacak Türkiye’de Ruhsatlı Olmayan Beşerî Tıbbi Ürün Bağışlarına İlişkin Kılavuz |
|
02/09/2022 |
Klinik Araştırmalar Dairesi Başkanlığı |
Klinik Araştırma Başvurularında Güven Uygulamaları Kılavuzu |
|
02/09/2022 |
Farmakovijilans ve Kontrole Tabi Maddeler Dairesi Başkanlığı |
Farmakovijilans Faaliyetlerinde Güven Uygulamaları Kılavuz Taslağı (Kılavuzun aslı 09.09.2022 tarihinde yayınlanmıştır) |
|
02/09/2022 |
İlaç Ruhsatlandırma Daire Başkanlığı |
Nitrozaminler Hakkında Bilgilendirme |
|
05/09/2022 |
Farmakovijilans ve Kontrole Tabi Maddeler Dairesi Başkanlığı |
İyi Farmakovijilans Uygulamaları (İFU) Kılavuzu Modül VII – Sinyal Yönetimi (Düzeltilmiş 1. baskı) |
|
07/09/2022 |
Strateji Geliştirme Daire Başkanlığı |
Beşeri Tıbbi Ürünler İçin Rutin Düzenleyici Süreçlerin Takip Edilemeyeceği Kriz ve Acil Durumların Yönetimi Kılavuzu |
|
09/09/2022 |
Farmakovijilans ve Kontrole Tabi Maddeler Dairesi Başkanlığı |
Farmakovijilans Faaliyetlerinde Güven Uygulamaları Kılavuz |
|
12/09/2022 |
İlaç Denetim Dairesi Başkanlığı |
İlaç Denetim Dairesi Kurum İçi İletişim Kılavuzu (24.09.2022 tarihinde revize edilen kılavuz yayınlanmıştır) |
|
15/09/2022 |
İlaç Ruhsatlandırma Daire Başkanlığı |
Beşeri Tıbbi Ürünlerin Ruhsatlandırma ve Ruhsat Sonrası İşlemlerinde İyi Değerlendirme Uygulamalarının İlkeleri ve Süreçleri Hakkında Kılavuz |
|
20/09/2022 |
İlaç Denetim Dairesi Başkanlığı |
Yurt Dışı Üretim Tesislerinin GMP Denetimleri İçin Yapılacak Müracaatlara Dair Kılavuz |
|
20/09/2022 |
İlaç Denetim Dairesi Başkanlığı |
Biyoyararlanım ve Biyoeşdeğerlik Çalışmalarının Yürütüldüğü Merkezler Hakkında Kılavuz |
|
24/09/2022 |
İlaç Denetim Dairesi Başkanlığı |
İyi Dağıtım Uygulamaları (GDP) Kapsamında Değerlendirilen Yerler İçin Başvuru Kılavuzu |
|
24/09/2022 |
İlaç Denetim Dairesi Başkanlığı |
Beşeri Tıbbi Ürün Tesisleri Başvuru Kılavuzu |
|
24/09/2022 |
İlaç Denetim Dairesi Başkanlığı |
İlaç Denetim Dairesi Kurum İçi İletişim Kılavuzu (Revizyon.01) |
|
25/09/2022 |
İlaç Ruhsatlandırma Daire Başkanlığı |
Beşeri Tıbbi Ürünler Ruhsatlandırma Yönetmeliğinde Değişiklik Yapılmasına Dair Yönetmelik |
|
26/09/2022 |
İlaç Ruhsatlandırma Daire Başkanlığı |
Beşeri Tıbbi Ürünlerin Ruhsatlandırma Sürecine İlişkin Güven Uygulamaları Kılavuzu |
|
30/09/2022 |
İlaç Denetim Dairesi Başkanlığı |
Aşı ve İmmun Serumlar Hakkında Seri Serbest Bırakma Yönetmeliği |
|
12/10/2022 |
İlaç Ruhsatlandırma Daire Başkanlığı |
Ruhsatlı Beşeri Tıbbi Ürünlerde Güven (Reliance) Kapsamında Sunulan Varyasyon Başvuruları Hakkında Duyuru |
|
13/10/2022 |
İlaç Denetim Dairesi Başkanlığı |
Aşı ve İmmun Serumlar Hakkında Seri Serbest Bırakma Yönetmeliği |
|
07/11/2022 |
İlaç Ruhsatlandırma Daire Başkanlığı |
• Sıkça Sorulan Sorular & Başvurularda Dikkat Edilmesi Gereken Hususlar dokümanları duyurusu |
|
16/11/2022 |
Farmakovijilans ve Kontrole Tabi Maddeler Dairesi Başkanlığı |
Farmakovijilans Sistemi Kılavuz Taslağı (05.12.2022 tarihinde Kılavuzun aslı yayınlandı) |
|
30/11/2022 |
Analiz ve Kontrol Laboratuvarı Dairesi Başkanlığı |
Türkiye İlaç ve Tıbbî Cihaz Kurumu Ulusal Kontrol Laboratuvarının Görev, Yetki ve Sorumlulukları İle Çalışma Usul ve Esasları Hakkında Yönetmelik |
|
05/12/2022 |
Farmakovijilans ve Kontrole Tabi Maddeler Dairesi Başkanlığı |
Farmakovijilans Sistemi Kılavuzu (30.11.2022 tarihinde yürürlüğe girmiştir) |
|
05/12/2022 |
Farmakovijilans ve Kontrole Tabi Maddeler Dairesi Başkanlığı |
İyi Farmakovijilans Uygulamaları (İFU) Kılavuzu Modül XI - Pazarlama Sonrası Yarar/Risk Değerlendirmesi Revizyonu |
|
12/12/2022 |
İlaç Denetim Dairesi Başkanlığı |
Farmakovijilans Denetim Kılavuzu |
|
12/12/2022 |
İlaç Denetim Dairesi Başkanlığı |
* İyi Dağıtım Uygulamaları Denetimlerine İlişkin Kılavuz
Revizyonu
|
|
13/12/2022 |
İlaç Denetim Dairesi Başkanlığı |
Denetim Hizmetleri Başkan Yardımcılığı Dış Paydaşlar İle İletişim Kılavuzu |
|
15/12/2022 |
İlaç Denetim Dairesi Başkanlığı |
Beşeri Tıbbi Ürün Tesisleri Risk Değerlendirme Başvuru Kılavuzu Revizyonu |
|
15/12/2022 |
Ekonomik Değerlendirmeler ve İlaç Tedarik Yönetimi Dairesi Başkanlığı |
Endikasyon Dışı/Yurt Dışı İlaç Kullanımına İlişkin Onay Sürelerinin Uzatılması Kararının İptali Duyurusu |
|
15/12/2022 |
İlaç Denetim Dairesi Başkanlığı |
Seri Serbest Bırakma Yeri Başvuru Kılavuzu Revizyonu |
|
15/12/2022 |
İlaç Denetim Dairesi Başkanlığı |
Üretim Yeri İzin Belgesi Yenileme Başvuru Kılavuzu Revizyonu |
|
15/12/2022 |
Ekonomik Değerlendirmeler ve İlaç Tedarik Yönetimi Dairesi Başkanlığı |
TİTCK Ek Onayı Alınmadan Kullanılabilecek Endikasyon Dışı İlaç Listesi güncelleme duyurusu |
|
16/12/2022 |
İlaç Ruhsatlandırma Daire Başkanlığı |
Beşeri Tıbbi Ürünler Ruhsatlandırma Yönetmeliğinde Değişiklik Yapılmasına Dair Yönetmelik |
|
21/12/2022 |
İlaç Denetim Dairesi Başkanlığı |
Beşeri Tıbbi Ürün Tesisleri Başvuru Kılavuzu Revizyonu |
|
23/12/2022 |
İlaç Ruhsatlandırma Daire Başkanlığı |
İlaç Ruhsatlandırma Dairesi Firma Görüşmeleri Hakkında Duyuru |
|
30/12/2022 |
İlaç Denetim Dairesi Başkanlığı |
Yurt Dışı Üretim Tesislerinin GMP Denetimleri İçin Yapılacak Müracaatlara Dair Kılavuz |
|
TARİH |
İLGİLİ KURUM/KURULUŞLAR |
GÖRÜŞÜLEN KİŞİ/KİŞİLER |
KONU |
|
16/02/2022 |
TİTCK Analiz ve Kontrol Laboratuvarları Dairesi Başkanlığı |
Doç. Dr. Mehmet Kürşat Derici |
AIFD iş birliği ile yapılabilecek çalışmalar hakkında değerlendirmelerde bulunuldu. |
|
25/02/2022 |
GSS İlaç Daire Başkanlığı |
Dr. Tuncay Alkan |
Nadir Hastalıklar ile ilgili güncel konular hakkında değerlendirmelerde bulunuldu. |
|
02/03/2022 |
TİTCK İlaç Eczacılık Başkan Yardımcılığı |
Dr. Asım Hocaoğlu |
Önceliklendirme Kılavuzu revizyonu
|
|
03/03/2022 |
TİTCK İlaç Ruhsatlandırma Daire Başkanlığı |
Uzm. Ecz. Handan Öztunca |
Önceliklendirme Kılavuzu revizyonu, Kısa Ürün Bilgisi (KÜB) ve Kullanma Talimatı (KT) başvuruları kapsamında yaşanan sorunlar ve DIA 2022 Organizasyonu hakkında değerlendirmelerde bulunuldu. |
|
23/03/2022 |
TİTCK İlaç Ruhsatlandırma Daire Başkanlığı |
Uzm. Ecz. Handan Öztunca |
Ruhsatlandırma süreçleri kapsamında güncel konular/sorunlar hakkında değerlendirmelerde bulunuldu. |
|
07/04/2022 |
TİTCK İlaç Eczacılık Başkan Yardımcılığı, TİTCK İlaç Ruhsatlandırma Daire Başkanlığı |
Dr. Asım Hocaoğlu, Uzm. Ecz. Handan Öztunca |
AIFD Güven çalışma grubu ile Güven Uygulamaları kapsamında hazırlanan sunum gerçekleştirildi ve karşılıklı değerlendirmelerde bulunuldu. |
|
14/04/2022 |
Sağlık Hizmetleri Genel Müdür Yardımcısı |
Doç. Dr. Mehmet Gündüz |
AIFD&IQVIA tarafından hazırlanan Nadir Hastalıklar raporumuz kapsamında değerlendirmelerde bulunuldu. |
|
26/05/2022 |
TİTCK & GSS |
Kamu Çalıştayı |
Önceliklendirme Süreçleri, Fiyatlandırma-Kur Politikaları, Paralel İhracat konularında karşılıklı değerlendirmelerde bulunuldu. |
|
22/06/2022 |
TİTCK Denetim Hizmetleri Başkan Yardımcılığı |
Dr. Ecz. Sevil Azak Sungur |
Yerinde denetim planlamaları, Beşeri Tıbbi Ürünler İmalathaneleri Yönetmeliği’nde yer alan Güven Uygulaması, GMP Önceliklendirme konuları kapsamında değerlendirmelerde bulunuldu. |
|
29/06/2022 |
TİSD, İEİS |
Dernek ve Sendika temsilcileri |
İyi Dağıtım Uygulamaları Kılavuzu kapsamında değerlendirmelerde bulunuldu. |
|
01/07/2022 |
TİTCK İlaç Eczacılık Başkan Yardımcılığı, TİTCK İlaç Ruhsatlandırma Daire Başkanlığı |
Dr. Asım Hocaoğlu, Uzm. Ecz. Handan Öztunca |
TİTCK’ya iletilen Sektör Sorunları Mektubumuz kapsamında değerlendirmelerde bulunuldu. |
|
03/08/2022 |
TİTCK İlaç Eczacılık Başkan Yardımcılığı |
Dr. Asım Hocaoğlu |
Önceliklendirme, ruhsatlandırma süreçleri, yayımlanması beklenen mevzuatlar, e-CTD ve iletişim konularında değerlendirmelerde bulunuldu. |
|
21/09/2022 |
TİTCK İlaç Ruhsatlandırma Daire Başkanlığı |
Uzm. Ecz. Handan Öztunca |
e-CTD geçiş planı, önceliklendirme süreçleri, Güven uygulamaları yaklaşımı, Sıkça Sorulan Sorular dokümanı, Birim randevuları gibi güncel konularda değerlendirmelerde bulunuldu. |
|
17/10/2022 |
TİTCK Başkanlık Makamı |
Dr. Asım Hocaoğlu |
Önceliklendirme süreci ve diğer sektörel sorunlar hakkında değerlendirmelerde bulunuldu. |
|
17/10/2022 |
Sağlık Bakan Yardımcılığı Makamı |
Doç. Dr. Tolga Tolunay |
Önceliklendirme süreci ve diğer sektörel sorunlar hakkında değerlendirmelerde bulunuldu. |
|
08/11/2022 |
TİTCK Başkanlık Makamı, TİTCK İlaç Ruhsatlandırma Daire Başkanlığı |
Dr. Asım Hocaoğlu, Uzm. Ecz. Handan Öztunca |
Önceliklendirme Kılavuzu, Ruhsata esas analiz süreçlerinin kaldırılması hakkında güncel durum, DSÖ Denetim süreci, TİTCK&AIFD İstişare Toplantısı, DIA 2023 katılımı konularında değerlendirmelerde bulunuldu. |
|
08/11/2022 |
TİTCK Denetim Hizmetleri Başkan Yardımcılığı |
Dr. Ecz. Sevil Azak Sungur, Kim. Müh Filiz Ozul |
Karşılıklı Tanıma Anlaşmaları (KTA), TİTCK olarak PIC/s Üyesi Ülkeler ile yapılabilecek KTA, Yerinde Denetim Planlamaları ve Sertifika Süreleri, TİTCK&AIFD İstişare Toplantısı, Denetimi yapılan tesislerin listesi, İyi İmalat Uygulamaları Değerlendirmeleri İçin Güven Kılavuzu konularında değerlendirmelerde bulunuldu. |
|
21/11/2022 |
TİTCK İlaç Ruhsatlandırma Daire Başkanlığı |
Uzm. Ecz. Handan Öztunca |
Ruhsatlandırma Yönetmeliği ve güncel konular hakkında değerlendirmelerde bulunuldu. |
İletilen Resmi Yazılar
|
TARİH |
İLGİLİ KURUM |
KONU |
|
28/01/2022 |
TİTCK İlaç ve Eczacılık Başkan Yardımcılığı |
Düzenleyici ve denetleyici faaliyetlerde güven uygulamaları (reliance) kapsamında bilgilendirme ve ülke örnekleri |
|
31/01/2021 |
TİTCK Ruhsat Koordinasyon Birimi |
AIFD üye firmalarından temin edilerek hazırlanan Sıkça Sorulan Sorular dokümanı |
|
08/02/2022 |
TİTCK İlaç ve Eczacılık Başkan Yardımcılığı |
TİTCK İstişare Toplantısı için AIFD Konuları |
|
14/03/2022 |
TİTCK İlaç ve Eczacılık Başkan Yardımcılığı |
İyi Dağıtım Uygulamaları Kılavuz Taslağı için AIFD görüşleri |
|
29/03/2022 |
TİTCK Bilgi Sistemleri Dairesi Başkanlığı |
ITS veri tabanı değişikliği süre uzatım talebi (4 dernek ortak yazısı) |
|
08/04/2022 |
TİTCK Bitkisel ve Destek Ürünleri Dairesi |
Sağlık Beyanı Kullanımı Hakkında Yönetmelik Taslağı için AIFD görüşleri |
|
19/04/2022 |
TİTCK İlaç Denetim Hizmetleri Başkan Yardımcılığı |
Ecza Ticarethaneleri ve Ecza Ticarethanelerinde Bulundurulan Ürünler Hakkında Yönetmelik Taslağı için AIFD görüşleri |
|
14/06/2022 |
TİTCK İlaç Ruhsatlandırma Dairesi |
Çeşitleme Kılavuzu kapsamında AIFD Soruları |
|
15/06/2022 |
TİTCK İlaç Ruhsatlandırma Dairesi |
Sektör Sorunları Mektubu |
|
15/06/2022 |
Sağlık Hizmetleri Genel Müdürlüğü, Otizm Zihinsel Özel Gereksinimler ve Nadir Hastalıklar Dairesi Başkanlığı |
Nadir Hastalıklar Sağlık Strateji Taslak Belgesi için AIFD Görüşleri |
|
07/07/2022 |
TİTCK İlaç Ruhsatlandırma Dairesi |
Nitrozamin süre uzatımı (4 dernek ortak yazısı) |
|
18/07/2022 |
TİTCK İlaç Denetim Dairesi Başkan Yardımcılığı |
Yurt Dışı Üretim Tesislerinin GMP Denetimleri İçin Yapılacak Müracaatlara Dair Kılavuz için AIFD görüşleri |
|
02/08/2022 |
TİTCK İlaç Denetim Dairesi Başkan Yardımcılığı |
AIFD üye firmalarından temin edilerek hazırlanan Sıkça Sorulan Sorular |
|
22/11/2022 |
TİTCK İlaç Ruhsatlandırma Dairesi |
Varyasyon Başvurusu, Değerlendirilmesi ve ilgili EBS süreçleri kapsamında AIFD üye firmaları tarafından yaşanan aksaklıklar, aksaklıklara dair çözüm önerileri |
|
02/12/2022 |
TİTCK İlaç Denetim Dairesi Başkan Yardımcılığı |
Revize Yurt Dışı Üretim Tesislerinin GMP Denetimleri İçin Yapılacak Müracaatlara Dair Kılavuzu için AIFD görüşleri |
|
16/12/2022 |
Sağlık Hizmetleri Genel Müdürlüğü, Otizm Zihinsel Özel Gereksinimler ve Nadir Hastalıklar Dairesi Başkanlığı |
Nadir Hastalıklar Sağlık Strateji Belgesi ve Eylem Planı kapsamında yapılacak çalıştay planlaması |
Toplantı/Sempozyum/ Kongre Katılımları
2022 yılı boyunca AIFD profesyonelleri tarafından çevrimiçi ya da fiziki olarak katılım sağlanan Toplantı/Sempozyum/ Kongreler aşağıda sunulmaktadır:
|
TARİH |
TOPLANTI/SEMPOZYUM/ KONGRE ADI |
|
20/01/2022 |
İstinye Üniversitesi Eczacılık Fakültesi Dış Paydaş Toplantısı |
|
15/02/2022 |
TİTCK Sektör İstişare Toplantısı |
|
23/02/2022 |
IPTS (International Pharmaceutical Technology Symposium) 2022 |
|
28/02/2022 |
SHGM Nadir Hastalıklar Farkındalık Günü Sempozyumu |
|
24/02/2022 |
Hacettepe Üniversitesi Dış Paydaş Toplantısı |
|
10/03/2022 |
8. Ulusal Hastane ve Kurum Eczacıları Kongresi |
|
28/03-01/04/2022 |
Drug Information Association (DIA) EUROPE Toplantısı |
|
28/05/2022 |
Metabolik Hastalıklar ve Beslenme Kongresi |
|
02/06/2022 |
Geleceğin Sağlık Teknolojileri Zirvesi TÜSEB |
|
20-21/10/2022 |
Bioexpo 2022 |
|
15/12/2022 |
10. DSÖ Ruhsatlandırma Prosedürlerinde İşbirliği Yıllık Toplantısı (WHO 10th Annual Meeting on Collaborative Registration Procedure) |
|
16/12/2022 |
Sağlık Ekonomisi ve Politikası Derneği (SEPD ) VI. Sağlık Ekonomisi Kongresi |
|
22/12/2022 |
Nadir Hastalıkların Geleceği Mükemmeliyet Merkezleri Sempozyumu |
Türkiye Odalar ve Borsalar Birliği (TOBB) İlaç Sanayi Meclisi alt komitelerinden Ruhsatlandırma ve Biyobenzer Alt Komitelerine AIFD olarak aktif katılım sağlanmıştır. Bu komitelerde sektörü temsilen dernek, sendika ve firmalardan katılımcıların iş birliği ile aşağıda belirtilen toplantılarda bir araya gelinerek sektörün ihtiyaçlarının yanında mevzuatlar üzerinden yapılan değerlendirmeler kapsamında TİTCK ile paylaşılmak üzere içerikler hazırlanmıştır. İlgili içeriklere dair sunumlar 26 Aralık 2022 tarihinde yapılan Türkiye İlaç Sanayi Meclisinde sunulmuştur.
|
TARİH |
TOPLANTI |
|
18/10/2022 |
TOBB İlaç Sektör Meclisi Ruhsatlandırma Alt Komitesi Toplantısı |
|
25/10/2022 |
TOBB İlaç Sektör Meclisi Biyobenzer Alt Komitesi Toplantısı |
|
08/11/2022 |
TOBB İlaç Sektör Meclisi Ruhsatlandırma Alt Komitesi Toplantısı |
|
15/11/2022 |
TOBB İlaç Sektör Meclisi Ruhsatlandırma Alt Komitesi Toplantısı |
|
22/11/2022 |
TOBB İlaç Sektör Meclisi Biyobenzer Alt Komitesi Toplantısı |

