RUHSATLANDIRMA
Ruhsata Erişim Süreleri
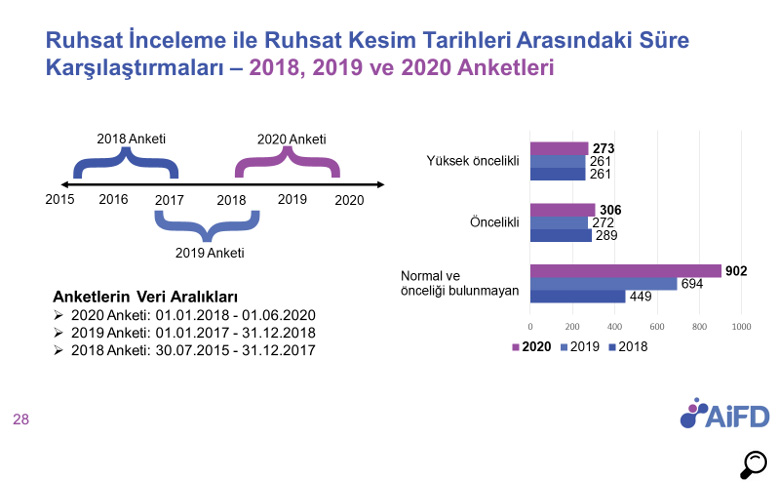
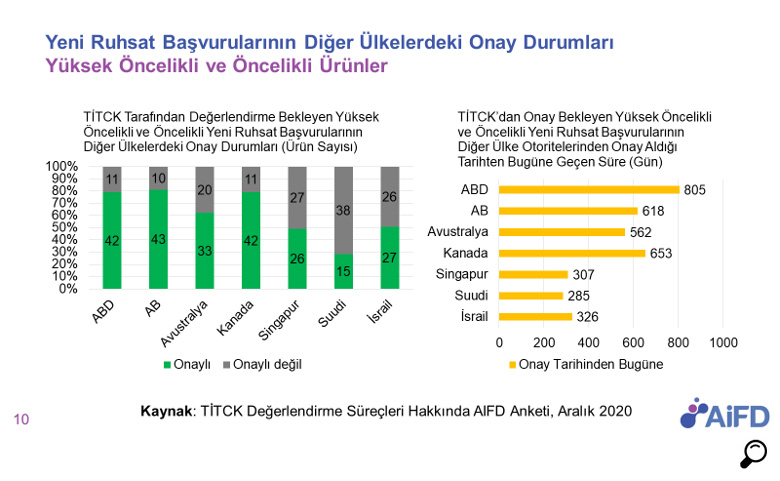
01.01.2018 ile 01.06.2020 dönemini kapsayan AIFD 2020 anket çalışmasının verilerine göre ruhsata erişim sürelerine bakıldığında;
- Yüksek öncelikli ve öncelikli ürünlerin ruhsat süreleri 2018 ve 2019 yılı verisi ile karşılaştırıldığında önemli bir değişme görülmemektedir. Yüksek öncelikli ürünlerde medyan süre 273 gün; öncelikli ürünlerde ise 306 gün olarak ölçülmüştür.
- Normal öncelikli/önceliği olmayan ürünlerde ise medyan süre 902 gün olarak ölçülmüştür, bu da 2018 ve 2019 verisi ile karşılaştırıldığında bu kategorideki ürünler için bir ilerleme sağlanamadığını, sürecin daha da uzadığını göstermektedir.
 Önceliklendirme Süreci
Önceliklendirme Süreci
“Yenilikçi İlaçlara Erişimin Hızlandırılması” kapsamında yapılan çalışmalardan birisi de Beşeri Tıbbi Ürünler Öncelik Değerlendirme Kurulu’nun çalışma usul ve esaslarına ilişkin kılavuzun revizyonuna yönelik AIFD görüş ve önerileri 2018 yılında TİTCK’ya sunulmuştu.
Kılavuz revizyonuna yönelik 2019 yılında herhangi bir gelişme yaşanmadı, öte yandan yenilikçi ilaçların önceliklendirme başvuruları sırasında 2 yıllık tahmini mali yük projeksiyonu istenmeye başlandı. Söz konusu uygulamanın yaratabileceği sorunlar şu şekildedir;
- Ruhsatlandırma yönetmeliğine göre, bir ürünün ruhsat alabilmesi için etkililiğinin, güvenliliğinin ve kalitesinin kanıtlanmış olması gerekmektedir ve bu doğrultuda başvuru sırasında herhangi bir maliyet bilgisi içermeden hazırlanmış dosya sunulmaktadır. Ruhsatlandırma sürecinde ürünün kamu maliyesine etkisine göre bir önceliklendirme değerlendirmesi yapılması, süreci tıbbi/bilimsel değerlendirme çerçevesinin dışına çıkarmaktadır. Sadece bilimsel veriler üzerinden klinik ve teknik bir değerlendirme içeren ruhsatlandırma sürecinde, yenilikçi bir ilacın maliyetinin süreci etkileyici bir unsur olarak ele alınmaması gerekmektedir.
- Önceliklendirme başvuru tarihinde ürünün birçok ülkede henüz fiyatı belirlenmemiş/ yayınlanmamış olabilmektedir. İlaveten, yeni tedaviler ilk pazara sunulduklarında referans ülkelerin dışındaki ülkelerde daha yüksek fiyatlarla pazarda yer alabilmekte ve kaynak fiyatın olduğundan yüksek görünmesine neden olabilmektedir. Bu nedenle, fiyat sağlanmış olsa dahi bu fiyatın güvenilirliği ve orta vadede geçerliliği belirsiz olacağından firmalar yenilikçi tedavi başvurularını öteleyebilmektedir.
- İlacın fiyatında belirleyici etkenlerden biri de pazar dinamikleridir. GMP/ruhsat başvuru aşamasında firmaların ilgili bilgilere henüz sahip olmaması ve/veya süreç devam ederken pazar dinamiklerinin değişmesi söz konusudur. Örneğin hastalıkla ilgili yeni çalışma/veri yayınlanabilir, başka ilaçlar piyasadan çekilebilir veya girebilir ya da mevcut tedaviler ile ilgili yeni deneyimler veya protokollerde değişiklik yaşanabilir.
- İlacın fiyatı ürünün belli başlı ülkelerde pazara verilmesinin ve ilk sağlık teknoloji değerlendirmelerinin ardından oluşmakta, tedavi protokolleri kılavuzlara bu aşamalarda eklenmektedir. Bu sebeple firmanın henüz karşılaştırma yapılabilecek tedavi protokolüne ve bu tedavinin maliyet verisine sahip olması oldukça zordur.
AIFD önceliklendirme sürecinin en başından beri fiyat taahhüdünden ve iki yıllık tahmini mali yük projeksiyonu gibi verilerden bağımsız olarak sadece bilimsel veriler üzerinden klinik ve teknik bir değerlendirme içerecek şekilde düzenlenmesini savundu.
Amerikan Gıda ve İlaç Dairesi (FDA), Avrupa İlaç Ajansı (EMA) ve Kanada İlaç ve Sağlık Teknolojileri Ajansı (CADTH) gibi dünya çapında referans alınan sağlık otoritelerinin önceliklendirme kriterlerine bakıldığında, ruhsatlandırma süreçlerinin sadece karşılanmamış tedavi ihtiyacı üzerinden tanımlandığı görülmektedir. Gelişmekte olan ülke otoritelerinin “karşılanmamış tedavi ihtiyacına” yönelik uyguladıkları hızlandırılmış ruhsatlandırma yolaklarına ve kabul kriterlerine bakıldığında kamu maliyesine etki ve cari açık gibi ekonomik kriterlerin önceliklendirme değerlendirmelerine dahil eden Türkiye haricinde bir ülke olmadığı görülmektedir.
Önceliklendirme sürecinin ana hedefinin “hastaların en iyi tedaviye, en hızlı erişimini sağlamak” olacak şekilde planlanmasından yola çıkarak başvurularda talep edilen bu verilerin hastaların yenilikçi tedavilere ulaşma sürelerinin uzamasına ve karşılanmamış tedavi ihtiyacının artmasına yol açacaktır.
Bu konu AIFD Yönetim Kurulu tarafından Sağlık Bakanlığı, Hazine ve Maliye Bakan Yardımcısı, TİTCK Başkanı ve Başkan Yardımcısı görüşmelerinde gündeme getirildi, yazılı olarak da tüm paydaşlara iletildi. Başvurularda talep edilen bu verilerin hastaların yenilikçi tedavilere ulaşma sürelerinin uzamasına ve karşılanmamış tedavi ihtiyacının artmasına yol açabileceği vurgulandı.
Bununla birlikte, AIFD üye firmaları arasında yapılan anket çalışması ile;
- Henüz fiyatı belirlenmediği için GMP önceliklendirme başvurusu yapılamayan yenilikçi ürünler bulunduğu, bu ürünler için öncelik alınamadığından dolayı da paralel ruhsat başvurusu yapılamadığı
- Ayrıca bu ürünlerin birçoğunun hali hazırda Avrupa Birliği ve Amerika sağlık otoritesi tarafından hızlandırılmış/öncelikli ruhsatlandırma süreçlerine tabi olarak değerlendirildiği görülmüştür.
- Önceliklendirme başvurusu yapılamayan ürünler ile ilgili Türkiye’de yürüyen 24 adet klinik çalışmasının olduğu tespit edilmiştir. Bu ürünler ile başlayan ruhsatlandırma süreçlerinde meydana gelecek uzama veya belirsiz ruhsat zamanlarının, ilerleyen günlerde yapılması planlanacak yeni klinik araştırma yatırımları üzerinde de olumsuz etkisi olacağı düşünülmektedir.
Dünyadaki ve ülkemizdeki ilk ruhsat onay zamanları arasındaki farkın kısaltılması, özellikle yenilikçi ilaçların hastalara erişimini hızlandırmak açısından son derece önemlidir. Ancak, Beşerî Tıbbi Ürünler Öncelik Değerlendirme Kurulu Çalışma Usul ve Esaslarına İlişkin Kılavuzda yer alan fiyat taahhütnamesi ve yeni talep edilen mali projeksiyonlar hem önceliklendirme hem ruhsat başvuru zamanını etkilemekte olup, sadece ruhsat onay süresinin değil başvuru süreleri arasındaki farkların da artmasına sebep olacaktır. GMP ve ruhsatlandırma süreçlerinin uzamasının bir sonucu olarak hastaların yenilikçi tedaviye erişimi için daha önceki yıllarda yaşandığı gibi TEB kanalı ile yurtdışından temin edilen ilaçların sayısında artış olması riski bulunmaktadır.
Yenilikçi ürünlerin kamu maliyesine olan etkisi baz alınarak önceliklendirme kararının verilmesi, Türkiye İlaç ve Tıbbi Cihaz Kurumu’nun global ölçekte kabul gören sayılı referans sağlık otoritelerinden biri olması vizyonunu sekteye uğratması ve hastaların yenilikçi tedavilere erişimini geciktireceği değerlendirilmektedir. Bu kapsamda, söz konusu uygulamanın bir an önce sonlandırılması için girişimlerimiz devam etmektedir.
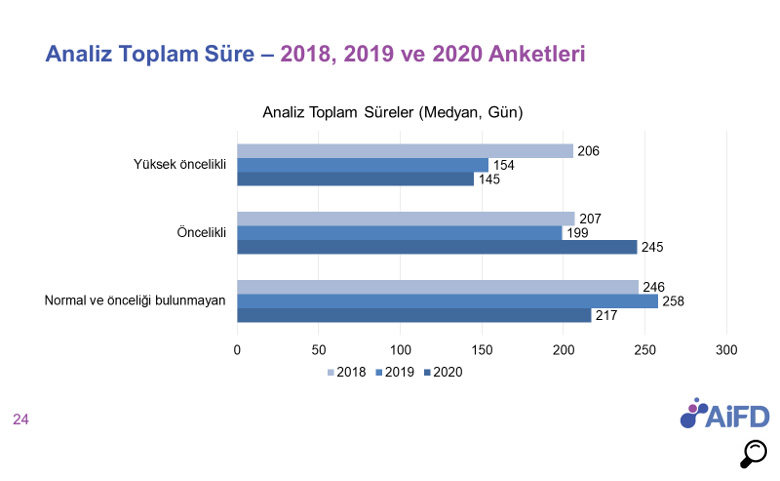
Ruhsata Esas Analiz
“Yenilikçi İlaçlara Erişimin Hızlandırılması” hedefinin bir diğer aksiyonu ise ruhsat aşamasındaki analiz sürecinin iyileştirilmesine yönelik oldu.
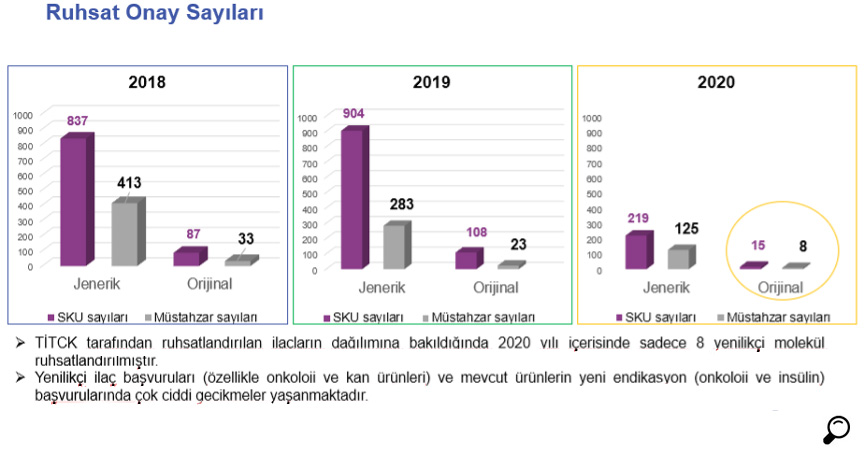
Analiz sürecinin ruhsatlandırmaya ilişkin diğer inceleme ve değerlendirme süreçleri ile paralel olarak yürütülmesine karşılık, bu sürecin başlı başına uzun sürmesi ve süreçte yaşanan çeşitli sorunlar ruhsat onaylarının gecikmesine neden olmaktadır. Bu gecikme özellikle ileri teknolojiye haiz biyoteknolojik ürünlerde ve kan ürünlerinde son zamanlarda daha fazla yaşanmaya başlanmıştır.
Temelde, ruhsata esas analiz sürecinin, yaşanılan sorunlar neticesinde ruhsatta gecikmelere neden olması sebebiyle, ruhsat kesimine engel teşkil etmeksizin ayrı bir süreç olarak piyasa kontrolleri çerçevesinde işleyebilmesi için gerekli kanun ve yönetmelik değişikliklerinin yapılması gerekmektedir.
Kanun ve Yönetmelikte önerilen değişiklik yapılmasına kadar geçecek olan süreçte yaşanılan sıkıntıların çözümüne ilişkin mevcut süreçlerde yaşanan sorunları ve çözüm önerilerimizi TİTCK yetkilileri ile paylaşmak üzere18.12.2019 tarihinde Ankara’da TİTCK & AIFD – Ruhsata Esas Analiz Çalıştayı” yapıldı.
Çalıştayda iletilen beklentilerimiz,
- Taslak yönetmelik ile ruhsata esas analiz sürecinin 210 günlük süreye dahil edilmesi
- Ruhsata esas analizi gerçekleştirilen ürünün analiz eksikliğinin ruhsat kesim aşamasında firmaya bildirilmesi süreci olumsuz yönde etkilediğinden analiz gerekliliklerine ilişkin Kurum içi yaklaşımında uyum sağlanması,
- Kanun ve Yönetmelikte önerilen değişiklik yapılmasına kadar geçecek olan sürede numune temini ve biyolojik/biyoteknolojik ürünler gibi hayati öneme haiz ürünlerin analiz sürecinde yaşanılan sıkıntılara yönelik çözüm önerilerinin geliştirilmesi,
Adına çözüm önerilerimiz Kurum yetkilileri ile paylaşıldı.
Yenilikçi İlaçların Endikasyon Onay Süreci
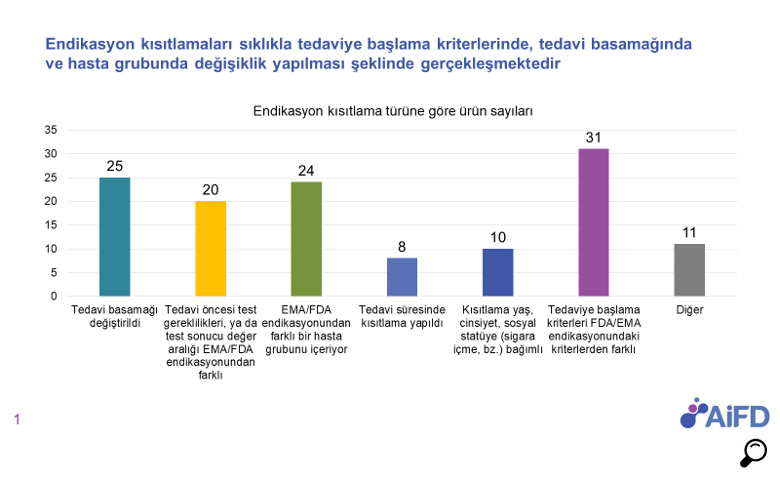
“Yenilikçi İlaçlara Erişim” in önündeki bir diğer engel ise; EMA ve FDA ile uyumlu endikasyonlar ile yapılan başvuruların değerlendirilmesi sırasında özellikle onkoloji, hematoloji, solunum, immünoloji ürünlerinde sıklıkla endikasyon kısıtlamaları ile karşılaşılmasıdır.
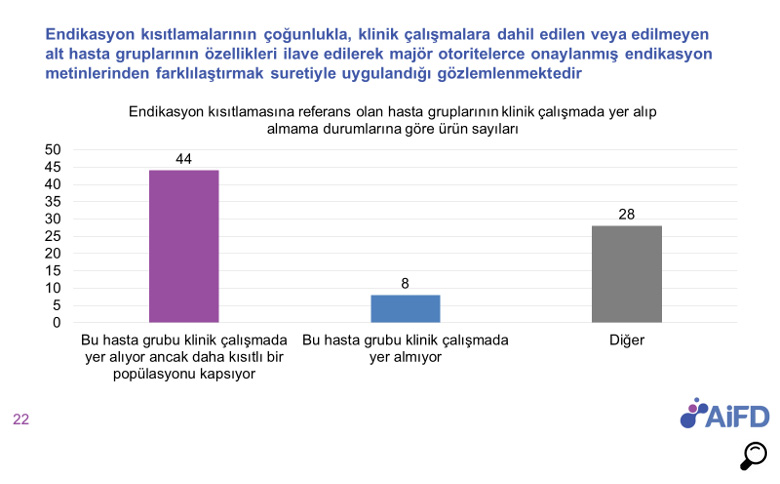
Bu yaklaşımdan dolayı son yıllarda oldukça zorlandığımız alanlardan birisi endikasyon değerlendirme süreçleri oldu. Endikasyon değerlendirme sürecinde aynı tedavi alanında endike olan ürünlere klinik çalışmalarından bağımsız ortak endikasyon verilmesi ve bilimsel değerlendirme sürecinde endikasyon metinlerine geri ödeme koşul /kriterlerinin eklenmesi gibi durumlar ürünlerin kendileri için gerçekleştirilen klinik çalışmalar ile uyumsuz endikasyonlar ile onaylanmalarına neden olmaktadır.
Bu durum; ürünlere ait bilimsel verilerin ülkemizde sağlık mesleği mensuplarına ilaçlarını tanıtmak amacıyla kullanılamaması gibi olumsuz sonuçlara neden olarak yenilikçi ürünlerin piyasaya verilmesinin gecikmesi veya Türkiye’de pazara sunulmama kararlarının verilmesine neden olmaktadır.
Endikasyon onayı verilirken değerlendirmelerin farmakoekonomik değerlendirme ve bütçe etkisi gözetilmeksizin tamamen bilimsel kanıtlara dayalı olarak değerlendirilmesi hastaların doğru ve etkin tedaviye erişimini sağlama açısından kritiktir.