DENETİM
Türkiye’de faaliyet gösteren 35 global ilaç şirketini temsil eden AIFD’nin vizyonu “Yenilikçi tedavi önerileri” sunarak, sağlık alanında yaşanan zorlukların aşılmasında ülkemiz sağlık sektörüne ve hükümetimize “çözüm ortağı” olmaktır. Buna bağlı olarak da en öncelikli hedeflerimizden biri;
Yenilikçi ilaçlara erişim – Türkiye’deki hastaların yenilikçi ilaçlara AB, ABD gibi ülkelerle benzer zamanlarda ve koşullarda ulaşmasıdır.
Avrupa İlaç Endüstrileri ve Birlikleri Federasyonu (EFPIA) tarafından her yıl yayımlanan GMP/GDP denetim anketinin 2019 verilerine göre Türkiye, Rusya, Amerika ve Japonya’dan sonra 2019 yılı içerisinde en yüksek yurtdışı denetimi sayısına sahip ülkeler arasında 4. sırada yer almaktadır.
EFPIA & AIFD Denetim Çalıştayı
EFPIA tarafından yürütülen denetim süreçleri anket sonuçlarının detaylı olarak AIFD üyelerine aktarılması ve konuyla ilgili soruların yanıtlanması adına EFPIA & AIFD iş birliği ile 8 Mayıs tarihinde çevrimiçi bir toplantı organize edildi. Bu toplantıda EFPIA Denetim Çalışma Grubu Üyesi Dr. Stephan Rönninger AIFD üyelerinde 2019 GMP anket sonuçları, Denetim Süreçlerinde Güven ve Karşılıklı Tanıma yaklaşımları hakkında bir sunum yaptı.
 GMP Denetim Süreçlerinde Karşılıklı Tanıma
GMP Denetim Süreçlerinde Karşılıklı Tanıma
İlacın kalitesi ve hastaların kullandıkları ilaçlara güven duymasından emin olmak için otoritelerin kurmuş oldukları etkin denetim sistemlerinin önemi şüphesiz çok kritiktir.
Bugün dünyada artık denetim kapasitelerinin en iyi şekilde kullanılabilmesi için küresel yaklaşımlar geliştirilmekte ve ülkeler arasında stratejik ortaklıklar kurulmaktadır. Bu sayede hastaların, nerede üretildiklerinden bağımız olarak tüm ilaçların kalite, güvenlilik ve etkililiğine güvenmesi sağlanmaktadır.
Bu yaklaşımın en son örneği olarak; Amerika İlaç ve Gıda Dairesi (FDA) denetim iş yükünü azaltmak amacıyla Avrupa İlaç Ajansı (EMA) ile iş birliğine gitmiş ve kaynaklarını potansiyel olarak halk sağlığı açısından daha riskli gördüğü gelişmekte olan ülkelerin GMP denetimleri için kullanmayı hedeflemiştir. Bu kapsamda, FDA 1 Kasım 2017 tarihinden bu yana toplam 28 Sağlık Otoritesi’ne GMP denetimleri için karşılıklı tanıma sağlamıştır.
Bu yaklaşım ilaçların kalitesini ve güvenliliğini korumak amacıyla, mevcut kaynakların kullanımını iyileştirmek için daha yakın bir işbirliği yolunda alınan önemli bir kilometre taşıdır. Dört yıl süren bir değerlendirme ve denetim sürecindeki özverili çalışmaları neticesinde TİTCK, 12 Eylül 2017 tarihinde PIC/S (Uluslararası İlaç Denetim Birliği) üyeliğine kabul edilerek 01.01.2018 tarihi itibarı ile, denetimleri tüm Dünya’da kabul görecek otoriteler arasına katılmıştır. Böylece, Türkiye’de üretilen ilaçların kalitesi ve güvenliği tescil edilmiş ve ülkemizde üretilen ilaçların Dünya pazarına açılmasının önündeki teknik engeller de ortadan kalkmıştır.
TİTCK’nın PIC/S üyeliği sonrası diğer ülkelerle karşılıklı tanıma anlaşmalarının yapılması görüşmelerinin devam etmekte olduğu bilinmekte ve bu doğrultuda anlaşmaya varılmış bir otorite bulunmamaktadır. Benzer bir yaklaşımla PIC/S üyeliği ile açılan yolda ülkemizin de karşılıklı tanıma anlaşmalarını yürürlüğe sokması Türkiye’nin küresel pazarlarda rekabetçi bir oyuncu olmasının önünü açacaktır.
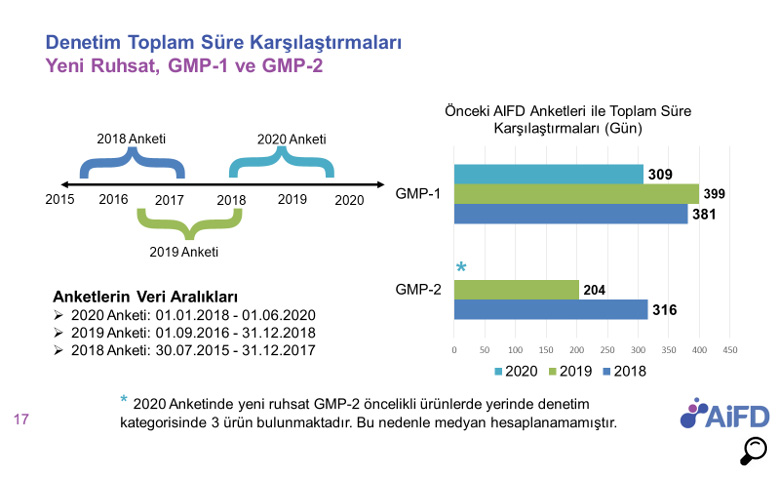
AIFD üyeleri arasında her yıl yapılan GMP denetim anket çalışmasını 2020 yılının ikinci çeyreğinde de başlatarak yeni süreçlerin performansı güncel olarak ölçüldü. Güncel sonuçlar yılın üçüncü çeyreğinde üyelerimiz ile paylaşıldı. AIFD’nin üyeleri arasında gerçekleştirdiği 01.01.2018 ile 01.06.2020 dönemini kapsayan 2020 anket çalışmasının verilerine göre;
- GMP denetimlerinde yüksek öncelikli ürünlerde (GMP‐1) medyan süre 309 gündür.
- 2020 Anketinde yeni ruhsat GMP-2 öncelikli ürünlerde yerinde denetim kategorisinde 3 ürün bulunmaktadır. Bu nedenle medyan hesaplanamamıştır.
- GMP-3 kategorili ürünler mevcut bir denetime eklenmediği durumlarda denetim yapılmadığı için süreler oldukça çok uzundur.